Développement et caractérisation de modèles de barrière hémato-encéphalique in vitro
Objectif de l’axe : Mise au point de modèles cellulaires de barrière hémato-encéphalique (BHE) pour l'étude de la physiologie et de la physiopathologie de la BHE.
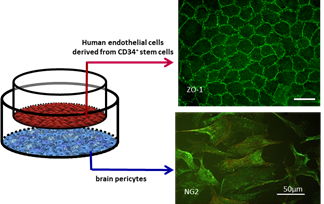
Le Laboratoire de la Barrière Hémato-Encéphalique a 35 ans d’expérience dans le développement de modèles in vitro de BHE à partir de cellules animales et humaines. Depuis 2013, le modèle mis en œuvre en routine au laboratoire est un modèle de BHE humaine, breveté et développé à partir de cellules souches CD34+ isolées à partir de sang de cordon ombilical. Ces cellules souches sont dans un premier temps différenciées en cellules endothéliales puis cocultivées en présence de péricytes pour l'acquisition du phénotype de BHE (jonctions serrées, expression de transporteurs d’influx sang-cerveau et d’efflux cerveau-sang, récepteurs). L’utilisation de péricytes humains permet d’exploiter un modèle syngénique
Ce modèle de co-culture, réalisé en plaque 12 puits est utilisé pour l’étude des modalités de variations de perméabilité, des mécanismes de transport des molécules à travers les cellules endothéliales de la BHE, de la toxicité des molécules dans des conditions physiologiques et physiopathologiques.
Nos participations en tant que workpackage leaders ou collaborateurs, collaboratrices dans de nombreux projets nationaux et européens ont été une aide substantielle dans le développement et la caractérisation de ce modèle :
Dans le projet FP7 "Eustroke" European Stroke Research Network, nous avons assumé la responsabilité de la partie modélisation de l’unité neurovasculaire (workpackage 1 : modelling of the neurovascular unit).
Dans le cadre du projet européen ITN "IN3", nous avons évalué la possibilité de modéliser la BHE à partir de cellules souches pluripotentes induites (iPSC) et d’utiliser ce modèle pour évaluer la toxicité chronique des xénobiotiques. L’avantage de ce modèle de BHE dérivé d’iPSC par rapport à celui utilisant des cellules souches hématopoïétiques présenté ci-dessous étant de pouvoir comparer les résultats à ceux obtenus dans des modèles d’autres organes (foie, rein, cerveau…) établis à partir des mêmes iPSCs et provenant donc du même donneur.
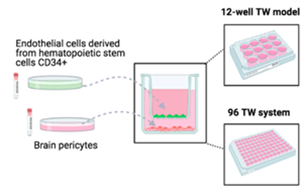
Lors de L’ITN "NANOSTEM" le modèle de coculture a été miniaturisé (plaque 96 puits) et automatisé en collaboration avec la société HCS PHARMA ( https://hcs-pharma.com/) afin de répondre à la forte demande des industriels du domaine de tester le passage et la toxicité de chimiothèques au niveau de la BHE humaine.
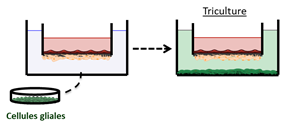
Si les études du transport des molécules à haut débit requièrent une simplification des modèles de la BHE, les études de la physiopathologie nécessitent au contraire, parfois, une complexification des modèles en y intégrant les différents acteurs de la composante glio-vasculaire (cellules endothéliales, péricytes, astrocytes, cellules microgliales) afin d’étudier d'un point de vue plus fondamental, les interactions cellulaires entre ces cellules. C’est ainsi qu’un modèle syngénique de BHE humaine en triculture (cellules endothéliales cultivées en présence d’astrocytes et de péricytes) a été mis au point. L’évolution perpétuelle de ce modèle et sa caractérisation sont renforcées par notre implication dans différents projets européens :
Dans le projet ERA-NET NEURON "IMatrix" où l’ajout de cellules microgliales a été envisagé.
Dans le cadre du projet TRANSCAN "ReachGlio" où l’utilisation de lignées cancéreuses permettent de mimer la barrière sang-tumeur.
|
|
| Modèle de BHE humaine (Cecchelli et al., 2014) breveté en mars 2013. Ce modèle conserve les propriétés de la BHE au moins pendant 20 jours de culture (protéines de jonctions serrées, transporteurs d'influx et d'efflux, récepteurs). |
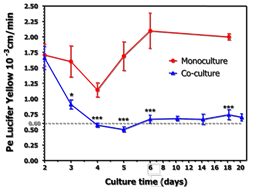
L’utilisation en routine d’un marqueur tel que le Lucifer Yellow permet de suivre l’intégrité de la barrière hémato-encéphalique in vitro dans les différentes configurations (monoculture, co-culture). |
|
|
| Le modèle de BHE humaine a été miniaturisé et automatisé dans le cadre du projet ITN NANOSTEM et en collaboration avec HCS PHARMA. |
L’ajout de cellules gliales pour mimer le compartiment cérébral a amené à concevoir un modèle tricellulaire de BHE humaine. |